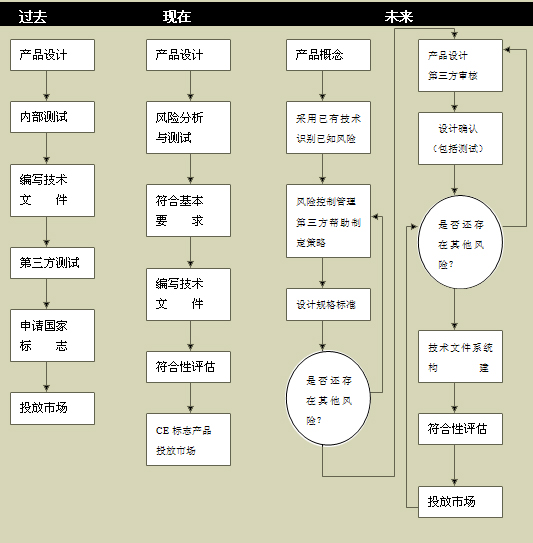
2002 年中期,美国 FDA 开始针对药品生产 cGMPs 发展了一套基于风险分析的科学方法,并在两年后就此发布了一份总结报告。这种基于风险分析的方法是针对企业的程序、系统、基础结构、组织机构以及文件系统所采用的一种系统分析方法。鉴于在风险水平和重要程度的层面上,不符合法规依从性的差距会存在差异,就此而言,该系统分析方法的出现,已经表明 FDA 官方对此已有足够的重视。 2003 年秋,也就是 21 CFR Part 11 (关于电子记录和电子签名的规范文件)发布生效后的第六年,对于 Part 11 的涵盖范围与应用问题, FDA 签发了符合预期的最终指南。从启动 cGMP 之初,到后来发布的指南文件, FDA 都建议行业采用基于风险分析的法规依从性解决方案,将解决法规依从性问题的努力,主要放在考虑最有可能影响患者安全、产品质量、以及(记录)数据的完整性等问题上。
采用上述 基于风险分析的方法,要求有关人员必须仔细考量、分析、理解并保持文件记录。目前生命科学工业正采用这种 基于风险分析的法规依从性解决方案,并倚重其实施自己的战略。更多详情,请浏览下述美国 FDA 官方网站:
www.fda.gov/oc/guidance/gmp.html
www.fda.gov/bbs/topics/news/2004/NEW01120.html .
 我们能为您
我们能为您
AQS顾问采用上述基于风险分析的方法,可以帮助客户完成法规依从性的状态评估、构建出系统的结构与范围、寻找差距并分析风险、确定改进方案,并建立执行计划。这一过程涉及各种人员、程序以及技术,覆盖了系统的生命周期。AQS的方法还可以替客户量身定做,以适应客户具体的内部环境。无论这一方法最终的综合程度或是专用化程度如何,均能帮助我们的客户识别、评估并控制风险,确保系统具有连贯性与完整性,有文件系统控制并易于审核、批准,易于区分风险次序,并易于跟踪与监控。
AQS可以帮助客户正式整合出一种符合商业程序驱动、基于风险分析的法规依从性解决方法。这种方法,将帮助客户降低不可预期的风险与商业障碍,区分风险次序,以便在寻求法规依从性补救措施和其他有关活动的问题上,更有效地分配资源,同时着重将资源用于那些对成长和获利影响关键的领域,其中包括在新技术方面的投资。客户将有机会重新评估、改进、优化系统生命周期(SLC)与计算机系统验证(CSV)方法,从而更有效地创造出更新的系统。
 AQS的优势
AQS的优势



